Đây là một bài viết tuyệt vời về hóa học lớp 12, với chủ đề là về kim loại kiềm thổ và những hợp chất quan trọng của chúng. Chúng ta sẽ khám phá những thông tin thú vị về các kim loại kiềm thổ và tác dụng của chúng trong bài viết này.
Vị trí trong bảng tuần hoàn, cấu hình electron nguyên tử
- Kim loại kiềm thổ thuộc nhóm IIA, gồm các nguyên tố: Be, Mg, Ca, Sr, Ba, Ra.
- Cấu tạo của chúng: cấu hình electron lớp ngoài cùng là ns2 (n là thứ tự của chu kỳ). Kim loại kiềm thổ có 2 electron ở lớp ngoài cùng.
.png)
Tính chất vật lí của kim loại kiềm thổ
Các kim loại kiềm thổ có màu trắng bạc, có thể dát mỏng, nhiệt độ nóng chảy và nhiệt độ sôi thấp, khối lượng riêng nhỏ.
Bạn đang xem: Hóa học lớp 12 Bài 26: Kim loại kiềm thổ và những hợp chất quan trọng của chúng
Tính chất hóa học của kim loại kiềm thổ
- Kim loại kiềm thổ có năng lượng ion hoá tương đối nhỏ, cho nên chúng có tính khử mạnh. Tính khử tăng dần từ Be đến Ba. Phản ứng thường diễn ra như sau: M → M2+ + 2e.
- Trong hợp chất của kim loại kiềm thổ, số oxi hoá thường là +2.
Tác dụng với phi kim
Thí nghiệm Đốt cháy Magie: (2Mg + O2 → 2MgO)
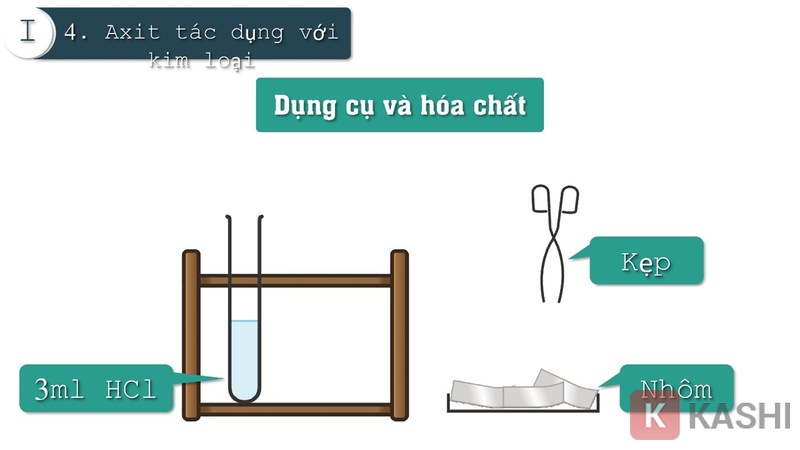
Tác dụng với dung dịch Axit
Thí nghiệm: (Mg + 2HCl → MgCl2 + H2↑)
Tác dụng với axit HNO3, H2SO4 đặc
- Kim loại kiềm thổ có thể khử N+5 trong HNO3 loãng xuống N-3, S+6 trong H2SO4 đặc xuống S-2.
- Thí nghiệm Magie trong axit sunfuric: (Mg + 5H2SO4 → 4MgSO4 + H2S↑ + 4H2O)
- Thí nghiệm Magie trong HNO3: (Mg + 10HNO3(loang) → 4Mg(NO3)2 + N-3 H4NO3 + 3H2O)
Tác dụng với nước
Thí nghiệm Canxi tác dụng với nước: Ca + 2H2O → Ca(OH)2 + H2↑

Canxi hidroxit
- Ca(OH)2 là một bazơ mạnh, dễ dàng hấp thụ khí CO2. Phản ứng: Ca(OH)2 + CO2 → CaCO3 + H2O.
- Ứng dụng của Canxi hidroxit: Sản xuất amoniac (NH3), Clorua vôi (CaOCl2) và nhiều ứng dụng khác.
Canxi cacbonat (CaCO3)
- CaCO3 dễ bị nhiệt phân thành CaO và CO2.
- CaCO3 tan dần trong nước khi có CO2: CaCO3 + CO2 + H2O → Ca(HCO3)2.
- Ứng dụng của Canxi cacbonat: Dùng làm vật liệu xây dựng, sản xuất vôi, xi măng và nhiều ứng dụng khác.

Canxi sunfat
- Canxi sunfat là một chất rắn màu trắng, tồn tại dưới dạng muối ngậm nước CaSO4.2H2O gọi là thạch cao sống.
- Khi đun nóng đến 1600C, thạch cao sống biến thành thạch cao nung. Phản ứng: CaSO4.2H2O → CaSO4.H2O + H2O.
- Ứng dụng của Canxi sunfat: Dùng để nặn tượng, đúc khuôn, bó bột khi gãy xương và nhiều ứng dụng khác.
Nước cứng và cách làm mềm nước cứng
- Nước cứng là nước có chứa ion Ca2+ và Mg2+.
- Nước cứng tạm thời được gây ra bởi các muối Ca(HCO3)2 và Mg(HCO3)2: Ca(HCO3)2 → CaCO3 + CO2 + H2O; Mg(HCO3)2 → MgCO3 + CO2 + H2O.
- Nước cứng vĩnh cửu được gây ra bởi các muối canxi và magie như CaCl2, CaSO4, MgCl2, MgSO4.
Tác hại của nước cứng
- Trong đời sống: sử dụng nước cứng để tắm giặt sẽ không sạch, làm quần áo nhanh hỏng.
- Trong sản xuất: tạo cặn, lãng phí nhiên liệu, tắc đường ống nước.
Cách làm mềm nước cứng
- Phương pháp kết tủa: sử dụng đun nóng, sử dụng NaOH, sử dụng Na2CO3 hoặc Na3PO4.
- Phương pháp trao đổi ion.
Nhận biết ion Ca2+ và Mg2+ trong dung dịch
Dùng dung dịch muối chứa CO32- sẽ tạo kết tủa CaCO3 và MgCO3. Sục khí CO2 dư vào dung dịch, nếu kết tủa tan chứng tỏ có mặt của Ca2+ và Mg2+.
Izumi.Edu.VN là trang web chuyên về giảng dạy hóa học và các môn khoa học tự nhiên khác. Truy cập https://izumi.edu.vn để tìm hiểu thêm thông tin và các khóa học hấp dẫn.
Nguồn: https://izumi.edu.vn/
Danh mục: Tài liệu hóa