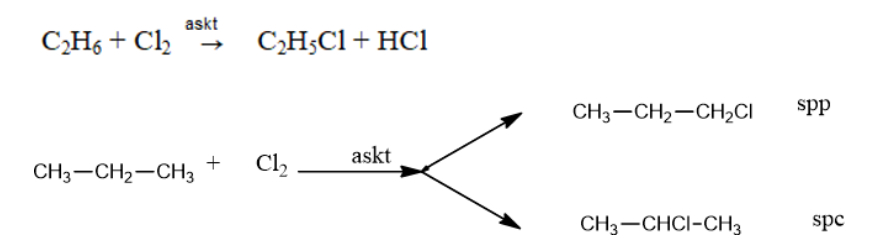
Hóa học là một trong những môn học khá phức tạp, đồng thời cũng là một môn học rất thú vị. Trong bài viết này, chúng ta sẽ cùng nhau tìm hiểu về một số khái niệm cơ bản về phản ứng hóa học và enthalpy.
- Bài tập hóa hữu cơ tuyệt vời dành cho sinh viên
- Đề thi HSG Hóa 8 cấp trường 2020 – 2021: Cùng tham khảo và luyện tập để thành công!
- Đáp Án Trắc Nghiệm Mô Đun 5 THCS: Đáp Án Trắc Nghiệm Cuối Khóa Module 5 Chương Trình Tổng Thể THCS
- Bài tập tự luận môn Hóa học lớp 11 – Chương 4: Đại cương về hóa học hữu cơ
- 213 Bài Tập Hóa Vô Cơ Đề Thi Thử THPT Quốc Gia 2023: Chuẩn Bị Tốt Cho Kỳ Thi Quan Trọng!
Phản ứng tỏa nhiệt và phản ứng thu nhiệt
Trước khi đi vào chi tiết, hãy xem xét hai phản ứng sau:
Bạn đang xem: Giải Hóa 10 Bài 14: Phản ứng hóa học và enthalpy
- Phản ứng nung vôi: CaCO3(s) → CaO(s) + CO2(g)
- Phản ứng than cháy trong không khí: C(s) + O2(g) → CO2(g)
Trong hai phản ứng trên, phản ứng nung vôi là phản ứng thu nhiệt, trong khi phản ứng than cháy trong không khí lại là phản ứng tỏa nhiệt.
Để hiểu rõ hơn, chúng ta cần tìm hiểu về khái niệm enthalpy – một đại lượng thường được sử dụng để mô tả lượng nhiệt được hấp thụ hoặc giải phóng trong một phản ứng hóa học.
.png)
Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
- Enthalpy tạo thành chuẩn của một chất hóa học
Enthalpy tạo thành chuẩn là lượng nhiệt kèm theo của phản ứng tạo thành một mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn. Ví dụ, enthalpy tạo thành chuẩn của Na₂O(s) không được coi là nhiệt tạo thành chuẩn nếu Na tác dụng với O₃ thu được Na₂O, vì O₃ không phải là dạng bền của oxi.
- Biến thiên enthalpy chuẩn của phản ứng hóa học
Biến thiên enthalpy chuẩn (∆rH₂₉₈o) của một phản ứng hóa học là lượng nhiệt kèm theo hoặc hấp thụ trong quá trình phản ứng, được tính từ enthalpy của sản phẩm trừ đi enthalpy của chất ban đầu. Ví dụ, phản ứng sau có biến thiên enthalpy chuẩn ∆rH₂₉₈o là -445,25 kJ:
12CH₄(g) + O₂(g) → 12CO₂(g) + H₂O(l)
Để tính biến thiên enthalpy chuẩn của một phản ứng, chúng ta cần biết enthalpy tạo thành chuẩn của các chất tham gia phản ứng và enthalpy tạo thành chuẩn của các chất sản phẩm.
Kết luận
Trên đây là một số kiến thức cơ bản về phản ứng hóa học và enthalpy trong môn hóa học. Hiểu về những khái niệm này sẽ giúp chúng ta có cái nhìn rõ hơn về sự tương tác giữa các chất và lượng nhiệt được tạo ra hoặc tiêu thụ trong quá trình phản ứng.
Nếu bạn muốn tìm hiểu thêm về các bài giảng và bài tập hóa học, hãy ghé thăm trang web Izumi.Edu.VN để có thêm nhiều thông tin bổ ích.
Nguồn: https://izumi.edu.vn/
Danh mục: Tài liệu hóa