- Các dạng bài tập Hóa 10 chương 2: Bài tập bảng tuần hoàn các nguyên tố hóa học và định luật tuần hoàn
- 20 chuyên đề giúp bạn trở thành học sinh giỏi môn Hóa lớp 9
- Lý thuyết Nitrogen – Hóa học 11 chương trình mới
- 100 Bài Tập Hóa Hữu Cơ Hay Và Khó Có Lời Giải Chi Tiết: Học Hóa Học 11 Nhanh Chóng và Chính Xác!
- Tự tin với công thức hóa học – Bước vào cánh cổng tri thức
Chào mừng bạn đến với Izumi.Edu.VN – nơi chúng tôi chia sẻ những bí mật hóa học hấp dẫn! Trong bài viết này, chúng tôi sẽ tổng hợp các công thức hóa học vô cơ lớp 11 để giúp bạn hiểu rõ hơn về các khái niệm quan trọng trong môn học này.
Bạn đang xem: Công thức hóa 11: Những bí mật tuyệt vời bạn cần biết!
Điện ly
Dung dịch

Biểu diễn thành phần dung dịch, nồng độ

Tích số tan

Độ điện li

Phân loại chất điện li
Dựa vào độ điện ly, chúng ta có thể chia chất điện li thành 2 loại.
Cân bằng điện li – Hằng số điện li

Mối liên hệ giữa hằng số điện li và độ điện li

Hằng số axit, hằng số bazơ
Hằng số axit

Hằng số bazơ

pH của dung dịch, chất chỉ thị màu

Khái niệm về độ pH, độ pH trong các môi trường

Chất chỉ thị màu

Cách xác định độ pH của dung dịch


Đối với axit yếu, bazơ yếu



Xác định pH đệm của dung dịch



Phản ứng trao đổi ion trong dung dịch chất điện li

Một số ví dụ về phản ứng trao đổi


Cách biểu diễn phương trình dưới dạng phân tử và ion


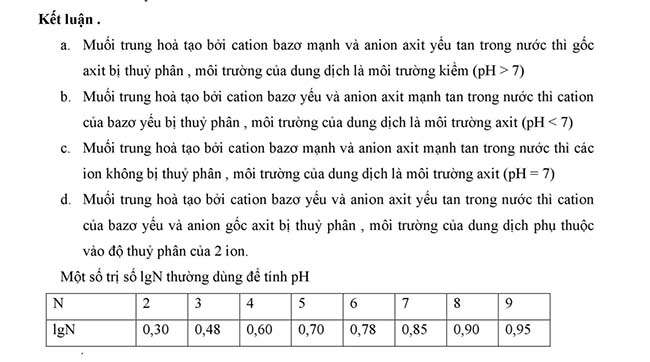
Phản ứng thủy phân của muối, môi trường của dung dịch muối

Phản ứng thủy phân của muối, xét sự thủy phân của các muối

Kết luận
Xác định pH dung dịch khi pha loãng bằng nước


Nitơ-Photpho
Tổng hợp các công thức hóa học lớp 11 phần Nitơ và hợp chất của Nitơ.
Công thức điều chế Nitơ
NH4NO2 → t° N2 + 2H2O
NH4Cl + NaNO2 →t° N2 + NaCl + 2H2O
Công thức điều chế NH3
NH4+ + OH- → NH3 ↑ + H2O
Các công thức hóa học liên quan đến hợp chất của Nitơ
Axit Nitric: HNO3
HNO3 không bền khi có ánh sáng sẽ phân hủy một phần tạo thành NO2. Công thức phân hủy như sau:
4HNO3 → 4NO2 + O2 + 2H2O
Bên cạnh đó, các bạn cần nhớ tính chất của HNO3 khi tác dụng với kim loại. Hợp chất của Nitơ này có thể oxi hóa hầu hết các kim loại, trừ Au và Pt.

Muối amoni NH4+ và NO3-
Một số công thức hóa học quan trọng.

Photpho
Tính oxi hóa, tính khử, axit phophoric và phản ứng thủy phân của muối Photphat.
Tính oxi hóa
Tính khử
Axit phophoric
Phản ứng thủy phân của muối Photphat
Cacbon – Silic
Cacbon
Tính oxi hóa của Cacbon khi tác dụng với hidro và kim loại.
Cacbonđioxit (CO2)
Phản ứng với dung dịch kiềm.
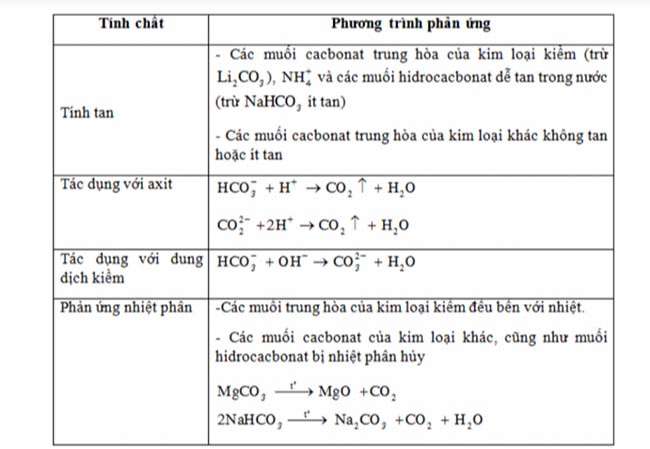
Muối cacbonat
CO2 phản ứng với dung dịch kiềm tạo ra 2 muối HCO3- và CO32-.
Silic và các hợp chất của silic
Các công thức hóa học về tính khử và tính oxi hóa của silic.

Công thức hóa học hữu cơ lớp 11
Xác định thành phần nguyên tố (m, %)

Xác định khối lượng phân tử của chất hữu cơ

Xác định công thức phân tử

Chủ đề lập công thức phân tử hợp chất hữu cơ
Xác định thành phần phần trăm khối lượng

Lập công thức đơn giản nhất
Lập công thức phân tử chất hữu cơ
Dựa vào phần trăm khối lượng các nguyên tố
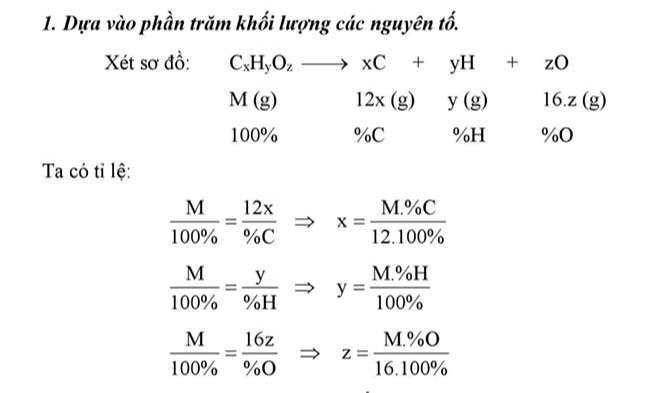
Thông qua công thức đơn giản nhất
Nếu đề bài không cho M thì để tìm n ta phải biện luận như sau
Tính theo khối lượng sản phẩm đốt cháy
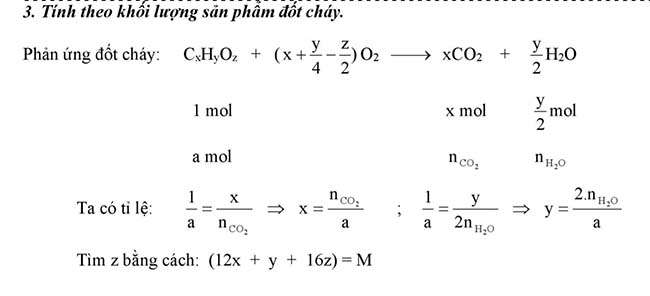
Vậy là chúng ta đã tổng hợp những công thức hóa học hấp dẫn từ lớp 11. Hy vọng bài viết này sẽ giúp bạn hiểu rõ hơn về các khái niệm quan trọng trong môn hóa học. Đừng quên truy cập Izumi.Edu.VN để khám phá thêm nhiều kiến thức bổ ích khác nhé!
Nguồn: https://izumi.edu.vn/
Danh mục: Tài liệu hóa