Bạn có muốn khám phá bí quyết thành công trong quá trình sản xuất hóa chất không? Hãy cùng Izumi.Edu.VN khám phá lý thuyết cân bằng hóa học và tìm hiểu cách áp dụng nó vào công việc của bạn. Hãy điểm qua những điều quan trọng dưới đây!
- Lý thuyết anken – Những bí mật về anken mà bạn chưa biết!
- Amoniac và muối amoni: Những bí quyết hóa học tuyệt vời!
- Sắt – Kim loại quý giá với nhiều tính năng đặc biệt
- Giải Hóa 10 Bài 26: Luyện tập nhóm halogen – Nắm vững kiến thức, tăng điểm ngay!
- Đề thi trắc nghiệm online Môn Hóa Lớp 8 tháng 1/2024
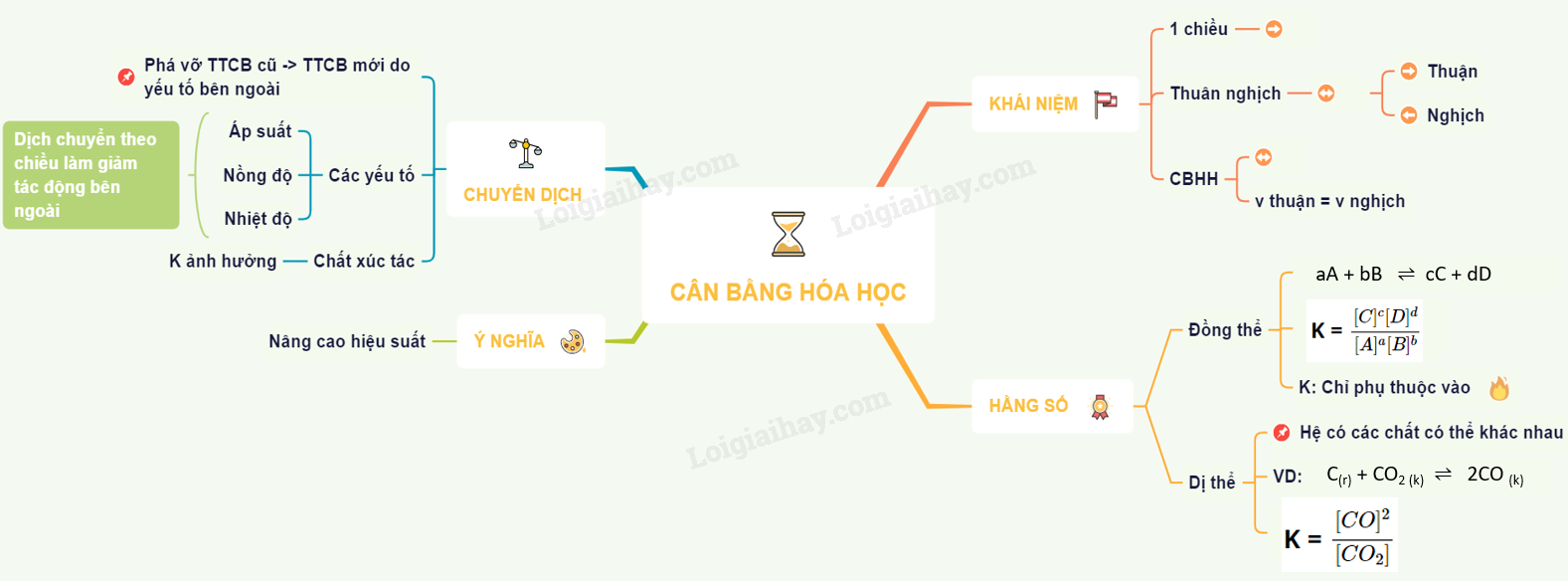
Phản ứng một chiều, phản ứng thuận nghịch và cân bằng hóa học
Phản ứng một chiều
- Phản ứng chỉ diễn ra theo một chiều, từ trái sang phải được gọi là phản ứng một chiều.
- Chất phản ứng hoàn toàn chuyển thành chất sản phẩm và không có phản ứng nghịch lại.
Phản ứng thuận nghịch
- Phản ứng hóa học trong đó chất phản ứng chuyển thành chất sản phẩm và đồng thời chất sản phẩm phản ứng với nhau để tạo thành chất tham gia phản ứng. Đây được gọi là phản ứng thuận nghịch.
Ví dụ: Cl2 + H2O (rightleftharpoons) HCl + HClO
Bạn đang xem: Lý thuyết cân bằng hóa học: Bí quyết thành công trong sản xuất hóa chất
- Chiều mũi tên từ trái sang phải là chiều của phản ứng thuận.
- Chiều mũi tên từ phải sang trái là chiều của phản ứng nghịch.
Cân bằng hóa học
- Cân bằng hóa học là trạng thái của phản ứng thuận nghịch, trong đó cùng một lượng chất sản phẩm được tạo thành từ những chất ban đầu trong cùng một đơn vị thời gian.
- Trạng thái này được gọi là cân bằng hóa học.
- Cân bằng hóa học xảy ra khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Hằng số cân bằng hóa học
Cân bằng trong hệ đồng thể
- Hệ đồng thể là hệ mà các tính chất lí học và hóa học đều như nhau ở mọi vị trí trong hệ.
- Ví dụ: hệ gồm các chất khí, hệ gồm các chất tan trong dung dịch.
- Hằng số cân bằng K của phản ứng xác định chỉ phụ thuộc vào nhiệt độ, không phụ thuộc vào nồng độ chất phản ứng.
- Trong trường hợp cân bằng giữa các chất khí, ta có thể thay đổi nồng độ bằng áp suất riêng phần của hỗn hợp.
Cân bằng trong hệ dị thể
- Hệ dị thể là hệ mà các tính chất lí học và hóa học không giống nhau ở mọi vị trí trong hệ, ví dụ: hệ gồm chất rắn và chất khí, hệ gồm chất rắn và chất tan trong nước.
- Hằng số cân bằng K được xác định dựa trên nồng độ các chất rắn.
Sự chuyển dịch cân bằng hóa học
Định nghĩa
Sự chuyển dịch cân bằng hóa học là quá trình phá vỡ trạng thái cân bằng cũ và chuyển sang một trạng thái cân bằng mới do yếu tố bên ngoài ảnh hưởng lên quá trình cân bằng.
Yếu tố ảnh hưởng đến cân bằng hóa học
- Nồng độ, áp suất và nhiệt độ là những yếu tố ảnh hưởng đến cân bằng hóa học.
- Nguyên lý Le Chatelier: Một phản ứng thuận nghịch ở trạng thái cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài khi bị tác động bởi nồng độ, áp suất hoặc nhiệt độ.
Ví dụ: Khi số mol khí ở hai vế của phương trình bằng nhau, tăng áp suất không gây chuyển dịch cân bằng.
Vai trò của chất xúc tác
- Chất xúc tác không ảnh hưởng đến nồng độ và hằng số cân bằng, do đó không gây chuyển dịch cân bằng.
Ý nghĩa của tốc độ phản ứng và cân bằng hóa học trong sản xuất hóa chất
- Lý thuyết cân bằng hóa học và tốc độ phản ứng hóa học giúp nâng cao hiệu suất trong quá trình sản xuất hóa chất.
- Ví dụ: Trong quá trình sản xuất H2SO4, cân bằng chuyển theo chiều thuận dẫn đến hiệu suất phản ứng giảm. Để cân bằng chuyển theo chiều nghịch, ta tăng nồng độ oxi (dùng lượng dư không khí).
Đó là những điều quan trọng về lý thuyết cân bằng hóa học mà bạn cần biết. Hãy áp dụng kiến thức này để nâng cao kỹ năng trong công việc sản xuất hóa chất của bạn. Tìm hiểu thêm tại Izumi.Edu.VN để khám phá những bí quyết khác trong lĩnh vực này.
Nguồn: https://izumi.edu.vn/
Danh mục: Tài liệu hóa