Anken là một khái niệm quen thuộc trong lĩnh vực hóa học. Nhưng bạn có biết rằng anken thực sự là gì và có những tính chất đặc biệt nào không? Hãy cùng Izumi.Edu.VN khám phá những bí mật thú vị về anken dưới đây!
Có thể bạn quan tâm
- Đại cương về hóa học hữu cơ: Những điều cần biết
- Hoá học và Vấn đề Phát triển Kinh tế: Ưu và nhược điểm của các nguồn năng lượng cơ bản trong tương lai
- Tuyển Tập 40 Bài Tập Hóa Học Nâng Cao Lớp 8
- Kế hoạch dạy học – Môn Hóa học 9 năm 2023-2024: Phân phối chương trình môn Hóa 9
- 20 chuyên đề giúp bạn trở thành học sinh giỏi môn Hóa lớp 9
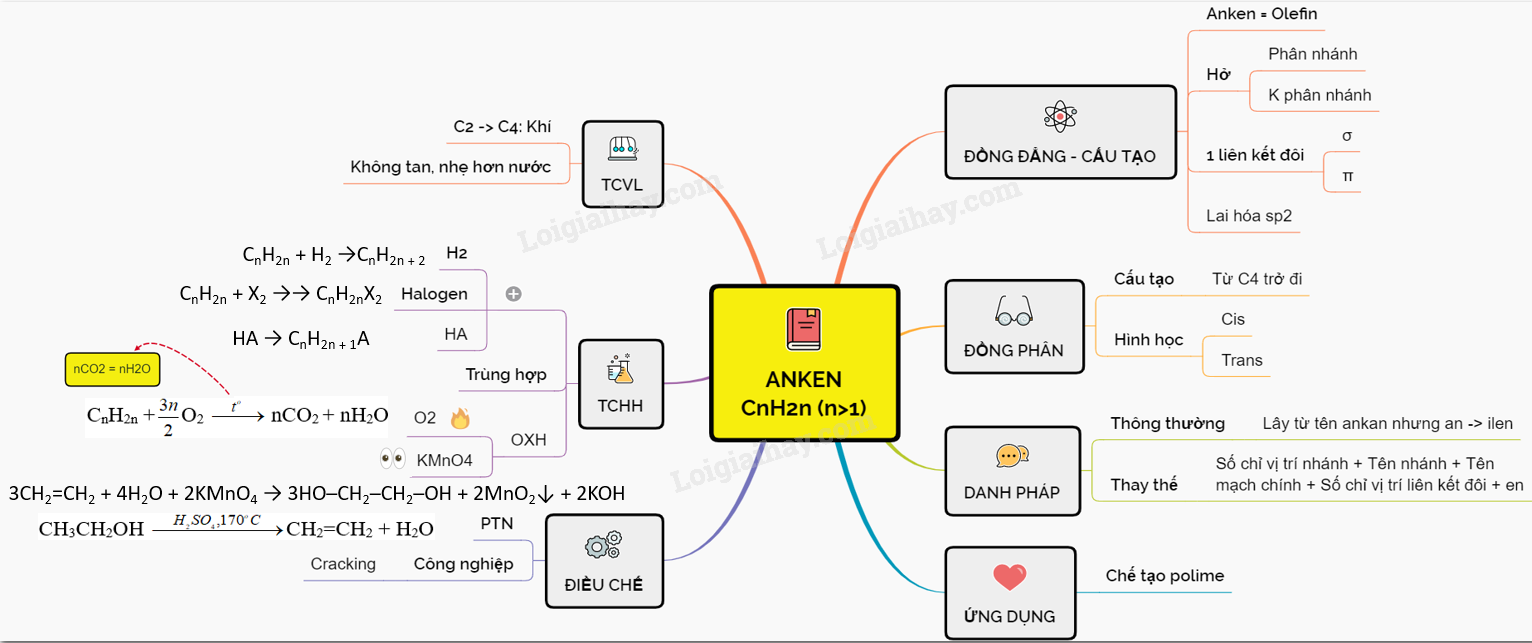
Đồng đằng, đồng phân, danh pháp
Đồng đằng, cấu tạo
- Anken là một dãy đồng đẳng được ký hiệu là CnH2n (với n ≥ 2).
- Anken còn được gọi là olefin.
- Công thức đơn giản nhất của anken là etilen (CH2=CH2).
- Anken là hợp chất cacbon có mạch mở, có thể có nhánh hoặc không có nhánh.
- Trong phân tử anken, có một liên kết đôi gồm liên kết σ và liên kết π. Cacbon trong liên kết đôi tham gia 3 liên kết σ thông qua lai hóa sp2 và liên kết π thông qua obitan p không lai hóa.
- Đặc biệt, phân tử CH2=CH2 có cấu trúc phẳng.
Đồng phân
a) Đồng phân cấu tạo
Bạn đang xem: Lý thuyết anken – Những bí mật về anken mà bạn chưa biết!
- Anken từ C4H8 trở đi có đồng phân cấu tạo với các loại mạch carbon và vị trí nối đôi khác nhau.
b) Đồng phân hình học
- Nếu mỗi carbon trong đôi liên kết đôi đều kết nối với hai nhóm nguyên tử khác nhau, ta có hai cách sắp xếp không gian khác nhau. Đây được gọi là đồng phân cis và trans.
- Cách đọc tên đồng phân hình học: thêm tiền tố cis- hoặc trans- trước tên gọi anken.
Danh pháp
- Một số anken được đặt tên thông thường bằng cách lấy tên từ ankan tương ứng và thay hậu tố an bằng ilen.
Ví dụ: CH2=CH2: etilen, CH2=CH-CH3: propilen. - Anken cũng có thể được đặt tên thay thế bằng cách sử dụng số chỉ vị trí nhánh – tên nhánh + tên mạch chính – số chỉ vị trí liên kết đôi – en.
Ví dụ: CH2=CH-CH2-CH3: but-1-en, CH3-CH=CH-CH3: but-2-en.
Tính chất vật lí
- Ở điều kiện thường, anken từ C2 đến C4 là dạng khí, từ C5 trở đi là chất lỏng hoặc rắn.
- Nhiệt độ sôi, nhiệt độ nóng chảy và khối lượng riêng tăng dần theo chiều tăng của phân tử khối.
- Anken nhẹ hơn nước và không tan trong nước.
Tính chất hóa học
Trong phân tử anken, liên kết đôi π không bền, điều này tạo điều kiện cho các phản ứng đặc trưng của anken.
1. Phản ứng cộng
- Các anken thường tham gia phản ứng cộng với các chất khác như hiđro, halogen, axit, và nước.
- Ví dụ:
- Cộng hiđro: CnH2n + H2 (xrightarrow{{Ni,{t^o}}}) CnH2n + 2
- Cộng halogen: CnH2n + X2 ( to ) CnH2nX2
- Cộng axit: Cộng nước, hiđro halogenua, axit sulfuric đậm đặc,…
2. Trùng hợp
- Trùng hợp là quá trình kết hợp nhiều phân tử nhỏ giống nhau hoặc tương tự nhau để tạo ra một phân tử lớn gọi là polime.
- Số lượng mắt xích trong một phân tử polime được gọi là hệ số trùng hợp.
3. Phản ứng oxi hóa
- Anken cháy hoàn toàn tạo ra CO2 và H2O và tỏa nhiều nhiệt.
- Anken làm mất màu dung dịch KMnO4 và bị oxi hóa không hoàn toàn thành hợp chất điol.
Ví dụ: 3CH2=CH2 + 4H2O + 2KMnO4 → 3HO-CH2-CH2-OH + 2MnO2↓ + 2KOH - Anken cũng dùng để nhận biết vì làm mất màu dung dịch KMnO4.
Điều chế và ứng dụng
- Trong phòng thí nghiệm, etilen thường được điều chế từ ancol etylic.
- Trong công nghiệp, các anken được điều chế từ ankan.
- Anken được sử dụng để tổng hợp các polime dùng cho nhiều mục đích, chuyển hoá thành các hoá chất hữu cơ như etanol, etylen glicol, anđehit axeticv.v.
Nếu bạn muốn tìm hiểu thêm về anken và các khái niệm liên quan, hãy truy cập Izumi.Edu.VN để khám phá thế giới kiến thức hóa học thú vị!
Thông tin được cung cấp bởi Izumi.Edu.VN
Nguồn: https://izumi.edu.vn/
Danh mục: Tài liệu hóa